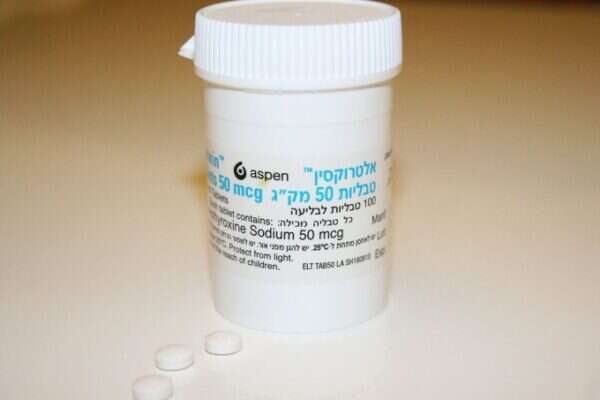
התפתחות דרמטית בפרשת תרופת האלטרוקסין: משרד הבריאות גילה כי השינוי בתרופה ששיווקה חברת פריגו בישראל החל מפברואר 2011 היה הרבה יותר גדול ומשמעותי ממה שהיה ידוע עד עתה. השינוי חל גם בחומר הפעיל והתרופתי המרכזי - ההורמון הסינתטי שלשמו נוטלים החולים את התרופה, ולא רק בחומרים הבלתי פעילים שעוטפים אותה. לפי שורת מסמכים פנימיים של משרד הבריאות, שהגיעו לידי "ישראל היום" ונחשפים כאן לראשונה, השינוי בחומר הפעיל לא דווח למשרד הבריאות על ידי החברה כשזו הגישה את התרופה לרישום בארץ, לא כאשר החלו להתגלות תופעות לוואי שמהן סבלו מאות חולים, ואפילו לא דווח לוועדת החקירה של משרד הבריאות, אשר סיימה את חקירתה בינואר 2012. להערכת בכיר באגף הרוקחות במשרד הבריאות, השינוי הזה יכול להסביר חלק מהתופעות הקשות ומסכנות החיים שמהן סבלו מאות חולים בישראל מאז הוכנסה התרופה החדשה. לפי המסמכים, המידע התגלה באיחור רב בחקירה שערך אגף הרוקחות של משרד הבריאות (מינואר עד מאי השנה), וזאת רק לאחר שנכתבו שוב ושוב מכתבים לחברת התרופות, שבהם נדרשה למסור את כל המידע על התרופה. משרד הבריאות מצידו לא דיווח ביוזמתו על הגילוי הנוסף בפרשה לקופות החולים, לרופאים ולכלל הציבור. על פי נתוני משרד הבריאות, כרבע מיליון ישראלים צרכו בכל יום את תרופת האלטרוקסין - התרופה העיקרית לטיפול בשיבוש הפעילות של בלוטת התריס. עוד עולה מהנתונים כי לאחר שיווק הגירסה החדשה של התרופה, לפחות כ-800 ישראלים סבלו מהפרעות ברמת ההורמון בגופם ומתופעות לוואי, חלקן קשות מאוד ומסכנות חיים. על פי ממצאי החקירה, הפרשה אירעה בגלל שורת כשלים ומחדלים - הן באגף הרוקחות במשרד הבריאות והן בחברות התרופות גלקסו-סמית-קליין (GSK) ופריגו הישראלית, שמייצגת את חברת אספן הגרמנית בארץ. בעקבות זאת הוגשה לפני כשבועיים בקשה לתביעה ייצוגית נגד חברות התרופות וקופות החולים מכבי וכללית, בדרישה לפיצויים בשמם של החולים שנפגעו מהשימוש בתרופה. טרם ניתנה החלטה בתביעה. לפי המידע שהעבירו תחילה חברות התרופות למשרד הבריאות, בתרופה החדשה שאושרה לשימוש השתנו ארבעה חומרים והמטרה המוצהרת של השינוי היתה שיפור יציבותה. ואולם באגף הרוקחות של משרד הבריאות גילו שחברות התרופות שינו לא רק את החומרים הבלתי פעילים בתכשיר, אלא גם ערכו שינויים בחומר הפעיל עצמו, כך שבתרופה החדשה הוא נמצא בחלקיקים גדולים יותר מאשר בתרופה המקורית. ממסמך פנימי של בכיר במכון לביקורת חומרי רפואה באגף הרוקחות עולה כי "במהלך ההתכתבות עם היצרן התגלה שהוא שינה את החומר הפעיל - מחומר פעיל בעל גודל חלקיקים קטן לחומר פעיל בעל גודל גס של חלקיקים, ללא שדיווח למשרד הבריאות... זהו שינוי מאוד מהותי באיכות התכשיר... גודל החלקיקים יכול להשפיע על התמוססות התרופה ועל זמינות התרופה לחולה... התנהלות היצרן במהלך החידוש היתה לא תקינה וכללה אינפורמציה חלקית, שלא לומר שגויה, ונשאלת השאלה איזו פעולה צריך לנקוט משרד הבריאות לאור התנהלות זו... הנהלת המשרד צריכה לשקול אם אפשר לנקוט צעדי עונשין נגד היצרן". במסמך נוסף כתב הבכיר באגף הרוקחות כי "איני מבין למה נדרשו כמה התכתבויות עד שהחברה חשפה את המצב האמיתי... יש כמה בעיות, המרכזית שבהן היא שיש הבדל משמעותי בהתמוססות התכשיר בין הפורמולה הישנה לפורמולה החדשה, שבה גם שונה גודל החלקיקים... צריך לעשות ניסוי לבדיקה אם יש הבדל בספיגה לפני ואחרי השינוי, דבר שאולי מסביר את תופעות הלוואי". ממשרד הבריאות נמסר כי "החברה לא דיווחה למשרד הבריאות על השינוי בגודל החלקיקים והנושא התגלה הודות לתחקיר מעמיק של המכון לביקורת במשרד הבריאות, אשר היה הגוף היחיד שגילה זאת ובדק מול החברה שלא דיווחה על כך. מידע זה לא התגלה בשום מדינה אחרת. עם זאת הדבר אינו מצדיק איסור שימוש בתרופה כבשאר מדינות העולם, ובשלב זה לא הוכח כי גודל החלקיקים גורם לתופעות לוואי... לאחר שהתגלה השינוי בגודל החלקיקים של החומר הפעיל נשלחה משלחת מקצועית של המכון לבקרה ותקנים של משרד הבריאות לערוך ביקורת תנאי ייצור נאותים אצל היצרן במפעל עצמו בגרמניה". מחברת פריגו נמסר כי החברה "דוחה את הטענות המועלות נגדה בכתבה. החברה משווקת את התרופה (ואינה יצרנית התרופה), לא הסתירה מידע ממשרד הבריאות והיא פעלה וממשיכה לפעול בהתאם לכל נוהלי משרד הבריאות לאורך כל הדרך. מעבר לכך, החברה עידכנה במכתב את הרוקחים על שינוי הפורמולציה כבר בחודש מארס 2011, ובאותו החודש נשלחו מכתבים לרופאים כדי לעדכן על השינוי ועל הצורך במעקב רפואי במהלך המעבר לפורמולציה החדשה. מכתבים נוספים נשלחו לרופאים ולרוקחים בחודש יוני 2011, ומכתבים נוספים נשלחו לרוקחים בחודשים אוגוסט ובספטמבר 2011". מחברת גלקסו-סמית-קליין נמסר: "החברה העבירה את המידע שהיה בידה לרשויות, כפי שהיא מקפידה לעשות לאורך שנים, והיא משתפת פעולה עם משרד הבריאות בתהליך שהחל במשרד לשיפור תהליך איסוף המידע לגבי תופעות לוואי בישראל".
היקף מחדל האלטרוקסין נחשף
השינוי בתרופה לבלוטת התריס חל גם בחומר הפעיל והמרכזי שלה • בכיר באגף הרוקחות: "זהו שינוי מאוד מהותי" • משרד הבריאות מתגונן: "מידע זה לא התגלה בשום מדינה אחרת"
Load more...